В начале XX века была создана теория строения атома, на основе которой периодический закон в настоящее время формулируется так: «Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атома.»
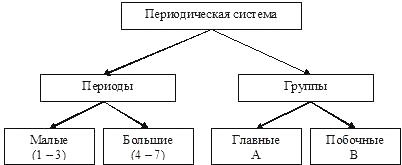
- Между положением элемента в периодической системе и его электронным строением существует связь.
- Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
- Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).
- Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы.
У элементов I и II групп электронами заполняется s-подуровень, поэтому они называются s-элементами. У элементов III-VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d-подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
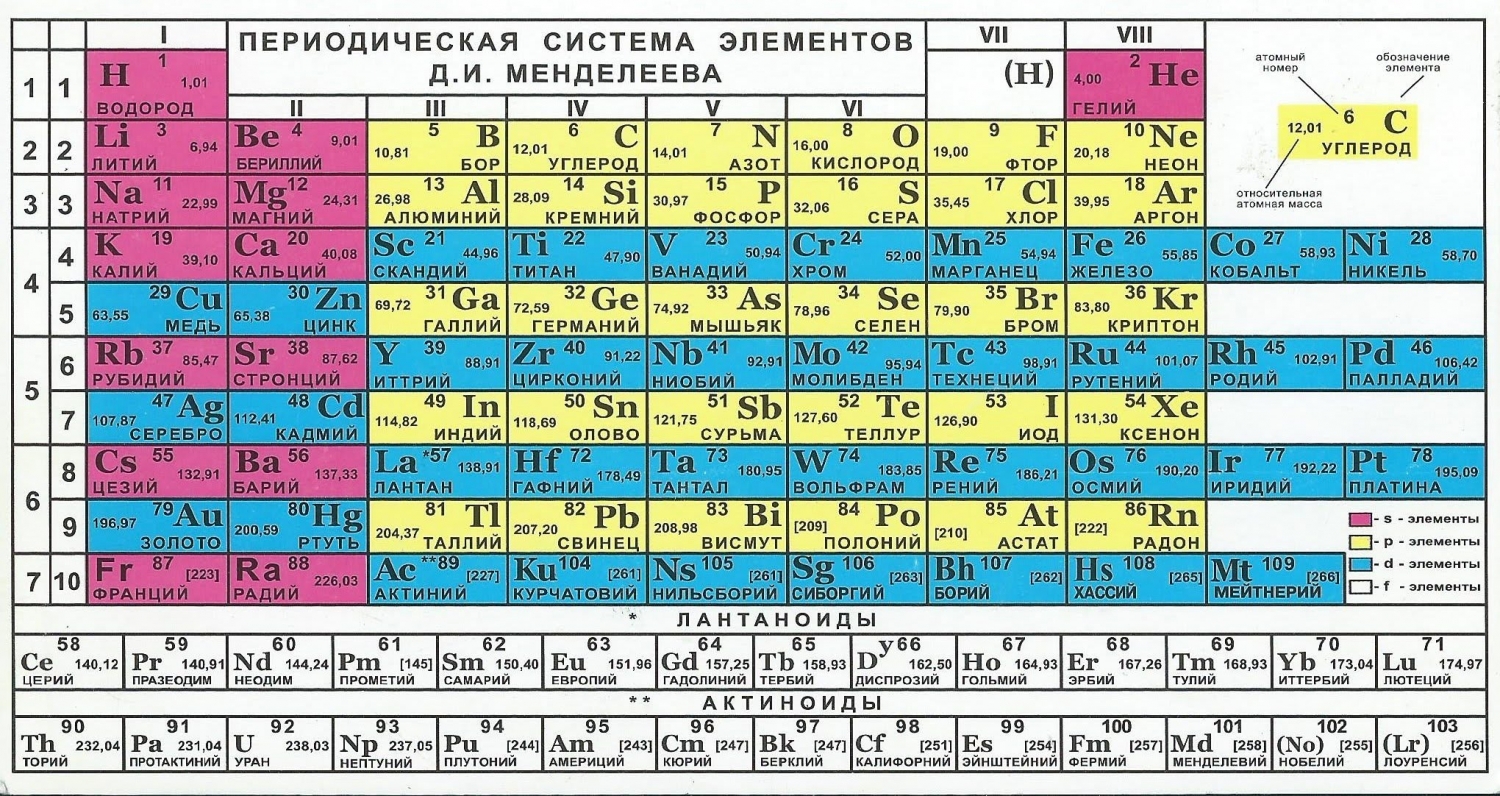
- Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
В периоде с возрастанием заряда ядра атомов металлические свойства уменьшаются, а неметаллические усиливаются. Это связано с увеличением числа электронов на последнем слое.
В главной подгруппе с возрастанием заряда ядра атомов металлические свойства усиливаются, а неметаллические уменьшаются. Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.

Периодическое повторение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и повторением электронных структур атома.
Химическая активность элементов определяется строением внешнего электронного слоя. Активность галогенов объясняется нехваткой 1 электрона до завершения внешнего слоя. У инертных элементов внешний электронный слой завершён, поэтому они химически неактивны. У атомов щелочных металлов 1 электрон на последнем слое является как бы лишним.
Полезные ссылки
Периодическая система как условная запись периодического закона (видео)
Характеристика элементов по положению в таблице Менделеева (видео)
Изменение свойств элементов и их соединений по периодам и группам (видео)
Периодический закон и Периодическая система химических элементов (видео)
Описание элемента по положению в Периодической системе (видео)
Закономерности изменения электроотрицательности элементов в группе и периоде (видео)
Дополнительные материалы
Периодический закон и периодическая система элементов Менделеева (видео)
Периодическая система элементов (видео)

Станьте первым, кто оставит
Авторизоватьсякомментарий к данному материалу.